Что такое озон

Озон - эффективный экологически чистый окислитель-дезинфектант, практически не имеющий конкурентов.
Особенно ценной особенностью озона является тот факт, что при его распаде в обрабатываемой среде не остается нежелательных веществ, подлежащих последующему устранению, поскольку единственным продуктом его разложения является кислород.
В этой статье мы попытаемся ответить на два принципиальных вопроса:
- В чем преимущества озона по сравнению с другими окислителями-дезинфектантами, в первую очередь, с хлором и двуокисью хлора?
- Почему озон, тем не менее, используется реже, чем хлор?
Введение
Озон был открыт в 1839 г. швейцарским химиком Христианом Шомбейном после экспериментов по электролизу кислот. За свой специфический запах Шомбейн назвал этот новый газ озоном, используя греческое слово "ozein" - пахучий. Очень скоро в результате ряда исследований было показано, что озон – это трехатомный кислород, газ , при стандартных условиях характерным свойством которого является его способность к окислению многих веществ и дезинфекция микрофлоры. Это свойство очень скоро было использовано в промышленности для обработки питьевой воды. В самом конце 90ых годов XIX столетия в Нидерландах и Германии делались попытки дезинфицировать воду для питья с помощью озона. Общепризнанной датой рождения озонной технологии водоподготовки принято считать 1906 г., когда во французском городе Ницце начала работать станция водоподготовки, носившая символическое название "Добрый путь" ("Bon voyage") с производительностью по воде 22,5 м³/сутки. Эта станция успешно работала до 1970 г., когда была модернизирована. Эта практика получила в дальнейшем широкое распространение, о чем свидетельствуют данные, приведенные на рис. 1. [1]
А) Рост использования озона на водопроводных станциях Германии
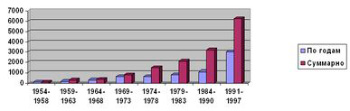
Б) Рост использования озона на водопроводных станциях США
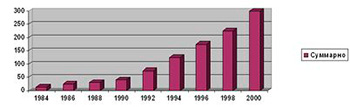
Рис.1 - Использование озона на водопроводных станциях
Для Германии (рис. 1 А) приведены данные по использованию озона в различных областях промышленности.В России эффективность озонирования для водоподготовки была оценена практически в то же время, что и за рубежом. В 1901 г. на пятом водопроводном съезде был заслушан доклад инженера Н. П. Зимина по озонированию воды; последний характеризовал "озонирование воды, как средство по устранению недостатков ее фильтрования при городских водопроводах". В 1905 г. при Петропавловской больнице в Санкт-Петербурге была введена строй экспериментальная установка по озонированию воды. Было установлено, что число бактерий снижалось в среднем на 98,8%, улучшался вкус и отсутствовал цвет очищенной воды. В 1911 г. в Санкт-Петербурге начала работать самая крупная в мире в то время станция озонирования воды. При ее открытии производительность обработанной воды составляла 44,5 тыс. м³/сутки. В дальнейшем, по понятным причинам, российская статистика применения озона существенно отличается от мировой и наше отставание в этой области один из важных факторов, как мы увидим дальше, влияющих на среднюю продолжительность жизни в стране. Обзор представлений об озоне, его получении и применении в различных областях в начале ХХ века дан в книге русского инженера В. В. Караффа-Корбутта "Озон и его применение в промышленности и санитарии", вышедшей в 1912 г. [2]. Одной из первых советских монографий на эту тему является книга В. Ф. Кожинова и И. В. Кожинова "Озонирование воды" [3]. Эти работы относятся к прошлому веку. За последнее время в производстве озона был достигнут значительный прогресс, позволяющий открыть новые, весьма перспективные, области использования озона.
1. Озон, его свойства и основные реакции с различными веществами.
Физико-химические свойства озона
Таб. 1.1. Основные физико-химические свойства озона
| Наименование параметра | Значение |
| Молекулярный вес | 49 г/моль |
| Температура кипения (при 1 атм.) | -111,9 °С |
| Температура плавления (при 1 атм.) | -192,7 °С |
| Плотность газа (при 0 °С) | 2,144 г/л |
| Растворимость в воде (от 0 ° до 30 °С) | В 13 раз выше, чем кислорода |
| Коэффициент растворимости в воде (0 °С/20 °С) | 0,49/0,29 |
Растворимость озона в воде
При растворении озона в воде, его концентрация постепенно повышается и достигает предельных значений для данных условий.Растворимость озона в воде может быть выражена либо в виде так называемого коэффициента Бунзеа - β, показывающего отношение объема растворенного озона, приведенного к нормальным условиям, к объему воды (Vоз/Vв), либо в абсолютных значениях растворенного озона (г/л). При этом считается, что процесс растворения подчиняется закону Генри, согласно которому количество растворенного озона пропорционально давлению газообразного озона над раствором.Этот закон может быть записан в виде:
Cстац = β*M*Pγ, г/л
Где: Cстац - растворимость озона, г/л; β – коэффициент Бунзена; M – плотность озона = 2,14 г/л; Pγ – парциальное давление озона в рассматриваемой газовой среде.
Следует отметить, что растворимость озона гораздо выше основных атмосферных газов - азота и кислорода, но слабее таких окислителей, как хлор и двуокись хлора.Растворимость озона быстро повышается с понижением температуры воды.
Разложение озона в воде
Одновременно с растворением озона в воде происходит его разложение. При этом скорость его распада, как и обратная величина "время жизни", зависит от температуры воды и, в основном, от состава воды - в первую очередь от наличия в воде различных примесей, особенно некоторых органических соединений и ионов металлов. Эти положения хорошо иллюстрируются данными, приведенными на рисунке 1.2.
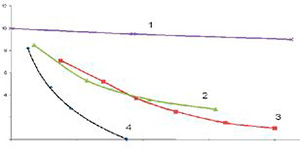
Рисунок 1.2. [4]. Разложение озона в различных видах воды при температуре 20 °С
1) Бидистиллят; 2) Дистиллят; 3) Вода "из-под крана"; 4) Фильтрованная вода; 5) Цюриховского озера. Время жизни в однократно дистиллированной воде 20 минут, а в обычной воде несколько минут.
Реакция озона с неорганическими веществами
Озон может реагировать с различными, находящимися в воде веществами по двум различным механизмам: непосредственно как озон (в молекулярной форме) и виде радикала ОН*, который возникает при распаде озона в воде. Считается, что в нейтральной воде эти 2 канала реакций распределены поровну. В кислой среде преобладает молекулярный механизм, а в щелочной - радикальный. Поскольку озон выступает в химических реакциях как окислитель, то можно судить о его окислительной способности по, так называемой, величине окислительного потенциала. Значение величин окислительных потенциалов различных веществ, являющихся окислителями, приведены в таблице 1.3.
Таб. 1.3. Значение величин окислительных потенциалов различных веществ
| Окислители | Окислительный потенциал (Вольт) | Относит. окислит. потенциал к ОК пот. хлор |
| Фтор | 3.06 | 2.25 |
| Гидроксил радикал | 2.80 | 2.05 |
| Атомный кислород | 2.45 | 1.78 |
| ОЗОН | 2.07 | 1.52 |
| Перекись водорода | 1.77 | 1.30 |
| Хлорноватистая кислота | 1.49 | 1.10 |
| Хлор | 1.36 | 1.00 |
| Бром | 1.07 | 0.74 |
| Диоксид хлора | 0.95 | 0.69 |
| Йод | 0.5 | 0.37 |
Из таблицы 1.3. следует, что озон является сильнейшим окислителем. Из стабильных веществ он уступает только фтору, резко превосходя хлор.Эффективность реакции озона с некоторыми неорганическими веществами можно оценить по начальным скоростям взаимодействующего с ними озона (точнее по удельным скоростям реакций, так называемым константам скоростей или их обратным величинам – временам реакций). Частично эти данные представлены на рисунке 1.3.
Реакция озона с металлами
Ионы железа и марганца быстро окисляются озоном до гидроксида железа и диоксида марганца. Перманганат также может быть образован по следующей реакции:
2Mn+2 + 5O3 +3H2O = 2MnO4- + 3O2 + 6H+
Параллельно с этим процессом происходит другой процесс – устранение марганца из раствора:
2Mn+2 +2O3 + 4H2O = 2MnO(ОН)2↓ + 2O2 + 4H+
Окисление ионов оксида марганца, кобальта и никеля происходит со скоростями, которые отвечают величинам констант скоростей порядка 1 л/моль сек. Удаление этих металлов происходит в процессах флокуляции-фильтрации.Хром может быть окислен до шестивалентного хрома . Процесс этот сложный, требует особых условий. Свинец окисляется озоном PbO2 c константой скорости реакции порядка 10 -10 л/моль сек. Металлы, образующие комплексы с EDTA, такие как Pb, Ni, Cd и Mn, сначала проходят стадию разрушения комплекса, а затем окисляются. Такие реакции воспроизводят условия комплексообразования этих металлов с природными гуминовыми кислотами.
Реакция озона с органическими соединениями
Электронная структура озона биполярна: с одной стороны - отрицательна, с другой - положительна.

По этой причине озон может реагировать одновременно как электрофильно, так и нуклеофильно. Обычно в реакции прямого окисления веществ озоном в воде преобладает электрофильный механизм.Кинетика потребления растворенного озона различными органическими соединениями была изучена Hoigne [12] и С.Д. Разумовским [13]. Частично эти данные приведены на рисунке [14]. Дать характеристику реакции всех основных органических веществ с озоном достаточно трудно. Рассматривая прямое воздействие озона, можно отметить некоторые общие положения. Насыщенные алкильные соединения реагируют с озоном очень медленно. Большинство хлорированных углеводородов и даже, ненасыщенные углеводороды не реагируют напрямую с озоном. В этом случае необходимо косвенное взаимодействие с озоном через радикал ОН. Бензол окисляется озоном очень медленно, а полициклические углеводороды быстрее.
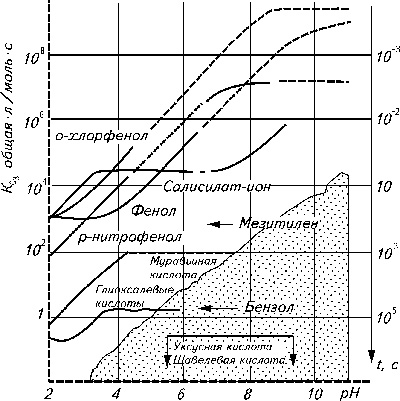
Рисунок 1.5. Значение констант химических реакций озона с некоторыми органическими веществами
Время реакции озона с фенольными соединениями составляет насколько секунд. Частично реакционная схема для фенола представлена на рисунке 1.5 [8]. Ион фената реагирует более быстро, чем протонированный фенол. Следует отметить, что константы скорости весьма велики и близки для фенолов различного строения [13]. Карбоксильные кислоты, кетовые кислоты и ряд подобных соединений представляют собой конечные стабильные продукты процесса окисления органических веществ озоном.• Амины при нейтральных значениях рН реагируют весьма медленно с озоном, при рН › 8 реакции окисления проходят быстрее. Однако, в основном, реакции окисления аминов идут через ОН радикалы. Четвертичные амины (ароматические амины) реагируют с озоном быстрее. Спирты могут взаимодействовать с озоном, образуя в качестве промежуточных соединений гидропероксиды. При этом они окисляются до карбоксильных кислот, в то время как вторичные спирты - до кетонов. Карбоновые кислоты с озоном реагируют слабо или не реагируют вообще.
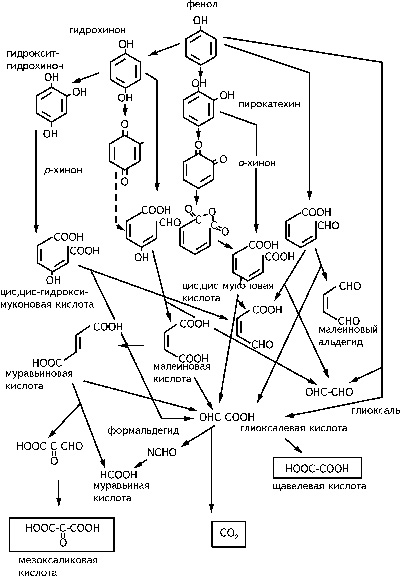
Рисунок 1.6. Схема превращений фенола в водном растворе
Меркаптаны окисляются с озоном до сульфоновых кислот. Бисульфиты и сульфоновые соединения являются промежуточными веществами. Аминокислоты, в состав которых входит сера (цистеин, цестин и метионин), реагируют быстро. Аминокислоты (составляющая часть белков) реагируют по электрофильному механизму. Среди пестицидов, содержащих эфиры фосфорной кислоты, наиболее известным является паратион. Озонирование этого соединения приводит к появлению параоксона, который более токсичен, чем паратион. Дальнейшее озонирование превращает параоксон в менее токсичные вещества (например, в нитрофенол, который затем окисляется до конечных продуктов - нитратов и СО2).
При обработке питьевой воды механизм прямого окисления через озон в молекулярной форме является основным. Константы скоростей большого числа органических соединений с озоном представлены в обзоре Hoigne [12].
2. Озон, как инактиватор микрофлоры
Как уже упоминалось выше, озон обладает мощным бактерицидным и вирулентным (инактивирующим вирусы) действием. В научной литературе (особенно популярной) часто утверждается, что озон действительно дезактивирует бактерии и вирусы сильнее, чем хлор (и это будет проиллюстрировано ниже), но к качественным оценкам этого преимущества надо относиться с определенными оговорками. Эффективность различных дезинфектантов хорошо иллюстрируется данными рисунка 2.1.
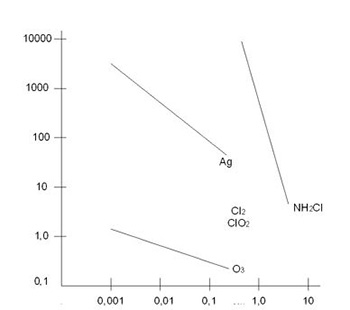
Рисунок 2.1. Скорость дезактивации патогенна Е-coli различными дезактивирующими агентами
В настоящее время при оценке эффективности того или иного дезинфектанта используются так называемые СхТ критерий, т. е. произведение концентрации реагента на время действия. Можно сказать, что ВОЗДЕЙСТВИЕ (ИНАКТИВАЦИЯ) = Концентрация * Время воздействия. В таблице 2.1. представлены для сравнения значения СхТ критерии для различных микроорганизмов – дезинфицирующих агентов.
Таблица 2.1. Значение СхТ критерия для различных микроорганизмов
(99% инактивации при 5-25 °С. СхТ критерий (Мб/л * мин)).
| Вид микроорганизмов | Озон рН:6/7 | Свободный хлор рН:6/7 | Хлорамин рН:8/9 | Двуокись хлора рН:6/7 |
| Е-coli | 0.02 | 0.03-0.05 | 95-180 | 0.4-0.75 |
| Полиовирусы | 0.1-0.2 | 1.1-2.5 | 770-3470 | 0.2-6.7 |
| Ротавирусы | 0.006-0.06 | 0.01-0.05 | 3810-6480 | 0.2-2.1 |
| Гардиалямблацисты | 0.5-0.6 | 47-150 | - | - |
| Гардиамюрисцисты | 1.8-2.0 | 30-630 | 1400 | 7.2-18.5 |
| Криптоспоридиум | 3.2-18.4 | 7200 | 7200 | 78 |
| Для 90% инактивации (1 log) |
Очевидно, что озон превосходит такие дезинфектанты, как хлор, хлорамин и двуокись хлора. Для такого патогенна, как кишечная палочка (Е-coli), озон более эффективен, чем хлор, но ненамного. В то же время для криптоспоридиума отношение С*Т критериев этих дезинфекторов приближается к 1000. Предполагается, что в принципе озону могут составить конкуренцию такие дезинфицирующие реагенты, как хлор, бром, йод, двуокись хлора и серебро. Молекулярный газообразный хлор, растворяясь в воде, распадается, производя хлористую кислоту HOCl, которая, в свою очередь, диссоциирует в воде на анион СЕО и катион Н. Степень этой диссоциации определяется кислотностью среды. Установлено, что при рН = 8 концентрация недиссоциироавшей кислоты ≈ 20%, а при рН = 7, концентрация НСlО ≈ 80%. Так как сильным бактерицидным действием обладает именно НСlО, то при использовании хлора (даже в виде гипохлорита) необходимо поддерживать оптимальное значение рН. Йод, как дезинфектант, используется для дезинтификации в небольших системах водоподготовки и иногда в плавательных бассейнах небольшого объема. По своим дезинцифицирующим свойствам йод слабее хлора и тем более озона, но он более удобен в транспортировке. Бром, в принципе, может использовать для целей дезинцификации, однако, в присутствии других окислителей он образует балласты, производные кислоты HbrO3 которые являются весьма вредными и им соответствует низкое значение ПДК. Эта проблема - образование броматов при озонировании бром содержащих вод - является достаточно серьезной и мы остановимся на ней в разделе "Использовании озона для подготовки питьевой воды". Кроме того, в последнее время отечественная и зарубежная промышленность предлагает ряд органических веществ, обладающих сильным дезинфицирующим действием. Однако все они имеют те или иные недостатки и большого распространения до настоящего времени не нашли. Долгое время использовался жидкий хлор из баллонов под давлением, что являлось большой проблемой с точки зрения безопасности. В настоящее время хлор получают в специальных аппаратах-хлоратах, при электролизе раствора поваренной соли или используют гипохлорит, который, растворяясь в воде, создает необходимую концентрацию свободного хлора. Надо отметить, что под термином "свободный хлор" понимают концентрацию хлорноватистой кислоты HСlO. Использование хлораторов вызывает необходимость в хранении запаса реагента, а гипохлорит при хранении разлагается и содержание свободного хлора падает. Озон производится на месте и все что нужно для его производства - это озонатор и электроэнергия.- Хлор ядовитый газ (ПДК для хлора составляет 1 мг/м³). Он впервые был использован как боевое отравляющее средство в первую мировую войну и жертвы его были многочисленны. Озон тоже относится к категории токсичных газов и его ПДК весьма низкий (0.1 мг/м³). К счастью, озон обладает чрезвычайно сильным характерным запахом и человек чувствует присутствие озона в воздухе гораздо раньше, чем его концентрация достигнет опасной величины (порог обоняния ≈ 0.1 / 0.5 ПДК). Необходимо подчеркнуть, что до настоящего времени неизвестно ни одного смертельного или даже тяжелого, требующего госпитализации, случая отравления озоном. Вопрос токсичности озона будет рассмотрен ниже отдельно. Одно из основных неприятных свойств хлора заключается в том, что при его реакции с большинством органических соединений возникает целый спектр хлорорганических производных, большинство из которых сильно ядовиты. Хлорфенолы и полихлорфенолы, особенно, так называемые диоксины, являются одними из сильнейших известных в настоящее врем органических ядов, причем действие этих токсинов заключается в разрушении иммунной системы человека. Так что, говоря о диоксинах, иногда используют термин "химический СПИД". Хлор очень легко взаимодействует с аммиаком, образуя хлорамины. Эти вещества обладают весьма слабым дезинфицирующим действием, но чрезвычайно сильно раздражают слизистые оболочки глаз и носоглотки. Хлорамины часто называют "связанным хлором". Этот связанный хлор в 5-10 раз более сильный раздражитель, чем свободный хлор. Озон также может образовывать промежуточные соединения (by products) при озонировании газовых и конденсированных сред. Теоретически можно допустить, что образующиеся by products более токсичны, чем озон. Эта проблема была предметом исследований многих ученых всего мира. Концентрации и состав промежуточных веществ, возникающих при озонировании, очень зависят от того, озонируется ли питьевая или сточная вода. Безусловно, в первом случае образуется гораздо меньше by products и состав их более очевиден. Все эти вопросы будут рассмотрены в соответствующих разделах обзора.
Можно резюмировать достаточно совпадающие вопросы многолетних исследований следующим образом:
- В подавляющем большинстве случае промежуточные продукты окисления загрязнителей озоном менее токсичны, чем исходные ингредиенты
- Прямое сопоставление промежуточных веществ, образующихся при сравнительных экспериментах по хлорированию и озонированию, показало, что в первом случае образуется гораздо больше by products [15].
2.1. Дезинфекции хлором и озоном на промышленных очистных станциях и в лабораторных условиях
Многолетняя история использования этих 2ух дезинфектантов на больших водоочистных станциях содержит богатый фактический материал, позволяющий судить об их преимуществах и недостатках. В упоминавшейся уже книге «Озонирование воды» [3] приводится ряд интересных примеров.Так за время длительной эксплуатации станции в Ницце в озонированной воде никогда не были обнаружены бактерии Escherichia coli и Clostridium pertringers.
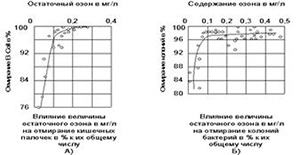
Рис. 2.2. Зависимость числа патогенных микроорганизмов от концентрации остаточного озона
2.4. Действие озона на споры, цисты и другие патогены
По отношению к этой микрофлоре озон также выступает как эффективный бактериальный агент. В частности по Брингманну Bacillus subtilis уничтожались в воде озоном в 3000 раз быстрее, чем хлором [18]. М. Кейн и Глекнер [18] изучали действие озона и хлора на цисты (плотные оболочки, образующиеся вокруг одноклеточных организмов) Endamoeba hystolica и на бактерии, сопутствующие этим культурам. Установлено, что время, необходимое для уничтожения этих организмов при остаточной концентрации озона 0.3 мг/л, составляет 2-7.5 мин, а для хлора (остаточная концентрация 0.5-1 мг/л) гораздо больше - 15-20 мин.
Действие озона на вирусы
Озон оказывает ярко выраженное, радикальное воздействие на многие вирусы, что сопровождается полной гибкостью вирусного протеина. Вирусологи США и Германии в 40х-60х годах провели ряд исследований с суспензиями вируса полиомиелита в целях его инактивации с помощью хлора, озона и двуокиси хлора [19]. Выводы из этих исследований могут быть представлены в следующем виде:
- Инактивация вируса полиомиелита хлором достигается дозой 0.1 мг/л при температуре воды 18 ºС, при температуре воды 7 ºС доза хлора должна быть не менее 0.25 мг/л
- Инактивация вируса с помощью озона достигается дозой 0.1 мг/л при температуре воды 18 ºС, для холодной воды -7 ºС доза должна быть повышена до 0.15 мг/л
- При использовании двуокиси хлора необходимо использовать дозу 0.6 мг/л (18 ºС). Для воды с температурой 7 ºС доза двуокиси хлора должна составлять 1 мг/л
По данным Науманна [20] возбудители полиомиелита уничтожаются озоном за 2 мин при концентрации 0.45 мг/л, тогда как при хлорировании дозой 1 мг/л для этого требуется 3 часа.
Озон и гидробионты
По мнению ряда авторов [22, 23] озон успешно устраняет микроводоросли и простейшие, активнее, чем хлор. Так, озон при концентрации 15 мг/л за 3 мин разрушает виды простейших, которые сохраняют свою активность при обработке воды дозой хлора 250 мг/л в течение продолжительного времени. Личинки моллюска дрейсены при дозе озона 0.9-1.0 мг/л погибли на 90%, при дозе 2 мг/л – 98%, при дозе 3 мг/л – полностью. Взрослые формы моллюска погибали при более длительной обработке озонированной водой (до 30 мин). Правда, цветущие водоросли, обычно бурно размножающиеся в открытых бассейнах на солнечном свете, слабо подвержены действию озона. Здесь используют ударные дозы хлора. Эту обработку проводят обычно ночью при профилактической чистке таких бассейнов. Подводя некоторый итог предельно краткому сопоставлению озона, хлору и двуокиси хлора, как агента для очистки и обеззараживания воды, отметим, что в определенном смысле этот спор был решен самой жизнью. Действительно, опыт работы водоочистительных станций, использующих озон и хлор, полностью свидетельствует в пользу озона. Так сопоставляя работу французской станции водоподготовки в Сен-Мор и станции в Чикаго (США) В. Ф. Кожинов [3] отмечает, что в первом случае болезни "водного происхождения" были зарегистрированы лишь в 1 случае на 100 тыс. жителей, хотя концентрация остаточного озона в воде не превышала 0.05 мг/л. В то же время в Чикаго имели место вспышки желудочно-кишечных заболеваний, несмотря на весьма значительное содержании хлора в водопроводной воде. Один из крупнейших гигиенистов прошлого века М. Т. Б. Уайтсон высказал на международном конгрессе по водоснабжению в Стокгольме (июль 1964 г.) такое мнение: "Наиболее существенным возражением против озонирования обычно считают отсутствие остаточного озона в разводящей водопроводной сети, тогда как при хлорировании в сети может быть обнаружен остаточный хлор". Эксперименты, проведенные в г. Аштоне (Англия) показали, что в обеззараженной озоном воде, циркулирующей в исправной водопроводной сети трубопроводов, не происходит ухудшения ее качества. Контрольные пробы озонированной воды, взятые из сети, оказались совершенно равноценными пробам, взятым из других источников, содержащих остаточный хлор в воде. Установлено также, что небольшое количество остаточного хлора, имеющееся в трубопроводах не может оказать никакого обеззараживающего действия на загрязнения, вызванные повреждениями коммуникаций. Т.е. присутствие остаточного хлора в трубопроводах еще не означает непременной бактериальной чистоты воды, хотя, зачастую, ее считают именно такой [16]. Один из авторов этого обзора обсуждал данную проблему с ведущими работниками цюриховского водопровода и они подтвердили мнение М. Т. Б. Уайтсона, что при использовании чистых труб в водопроводных сетях повторного заражения озонированной воды не происходит. Даже из этого краткого сопоставления озона с другими окислителями-дезинфектантами преимущества озона бесспорны. Из-за краткости обзора мы не останавливаемся здесь на таких положительных свойствах озона, как усиление процессов коагуляции-флоккуляции, эффективное проведение процесса микрофлоккуляции, несравненно более высокое качество воды в плавательных бассейнах, использующих озон вместо хлора и ряд других. Наконец, проблема стоимости. Бытует мнение, что озонирование значительно дороже хлорирования. Однако это не так. В процессе хлорирования возникает необходимость устранить излишний хлор из воды, провести так называемое дехлорирование. Для получения воды удовлетворительного качества это приходится делать, применяя специальные реагенты. С учетом этого фактора, а также тенденций непрерывного понижения цены на озонаторное оборудование и повышение цены на хлор и хлор-продукты, в настоящее время стоимость этих процессов почти сопоставима. Тем не менее, хлорирование, если говорить о нашей стране, используется чаще, чем озонирование. Почему? Есть несколько причин: - психологическая причина. Работать с хлором, особенно если речь идет о баллонах с жидким хлором, сравнительно просто. Достаточно отвернуть вентель баллона или вылить в бассейн ведро гипохлорита, как все проблемы с дезинцификацией решены. Это, безусловно, проще, чем следить за концентрацией озона, выходящего из озонатора, учитывая, что озонатор сравнительно сложный аппарат и надо быть уверенным, что он неожиданно не отключится; - вот здесь и возникает вторая (а может быть и первая) причина слабой распространенности озона. До самого последнего времени надежность озонаторного оборудования оставляла желать лучшего, а низкий уровень автоматизации предполагал необходимость использования обслуживающего персонала относительно высокой квалификации. Существенный прорыв в проблеме создания надежного, несложного в использовании озонаторного и озоноизмерительного оборудования стал возможен после появления современных IGBT транзисторов, позволивших резко упростить и удешевить производство импульсных высоковольтных генераторов, развитие микропроцессорной техники и новых типов ультрафиолетовых сенсоров, современных синтетических цеолитов и пр. Все это, а также полученные результаты исследований импульсных электрических разрядов в воздухе, позволило разработать новые технологические решения, открывшие совершенно новые возможности для производства озонаторов неосушенного воздуха, кислородных озонаторов, систем контроля остаточного озона в воде, озонометров, концентраторов кислорода и другого оборудования, делающего применение озонирования гораздо более простой и удобной технологией, чем она была раньше. Мы рады, что наши исследования и разработки, защищенные патентами в России, США, Японии и других странах помогают делать жизнь людей более простой, безопасной и, будем надеяться, более долгой.
Список литературы
[1] Драгинский В.Л., Алексеева Л.П., Самойлович В.Г. «Озонирование в процессах очистки воды» М. Дели принт. 2007 г.
[2] Инж. В.В. Караффа-Корбутть«Озонъ и его применение въ промышленности и санитарiи» Изд. «Образование» СпП. 1912 г.
[3] В.Ф. Кожинов, И.В. Кожинов «Озонирование воды» М. Стройиздат 1973 г.
[4] В.В. Лукин, М.П. Попович, С.Н. Ткаченко «Физическая химия озона» Изд. МГУ 1998г.
[5] Manley Т.С., Negowski S.J. «Ozone» in Encyclopedic of chemical Technology. Second Ed. Vol 14. N.J. 1967.
[6] Hozvath M.H., Bilitrki, haud., Huttez. «Ozone» Ed. Akademie. Kiado. Budapest 1987
[7] Коган Б.Ф. и бр. «Справочник по растворимости» т.1, кн. 1, М. 1961.
[8] Masschelein W.J. «Processes unitaixes du treatmeut de l esu potable» Ed. CEBEIOC. Hiege. 1996.
[9] Jore M., hegube B.J. Er. Hydrol. 14.11.1983.
[10] Cowen W.Fetal. «Chemistry in water reuse». Ed. Ann. Azboz. Science Publ. Michigan. 1985.
[11] Curol M.D. Env. Prog. 4.46.1985.
[12] Hoigne J. «In Progress Technologies for water treatment» Ed. Plenum. Press №3. 1988
[13] Розумовский С.Д. и Заиков Г.З. «Озон и его реакции с органическими соединениями» М. 1974.
[14] Hubner R. Gesundheitstechnik №12. 1973.
[15] Dojbido J. Etol. «Образование промежуточных веществ в процессе озонирования и хлорирования» Wat. Res. 1999.
[16] Ridenour G.M., Inglols R.S. «American Jounal of Public Health» 1946. 3.6p 639.
[17] Gomella C. 2e treitment d eux par l ozone. «Extract du mensuel» du ceutre Belge 287. 1967.
[18] Кожинов В.Ф. Озонирование воды. «Городское хозяйство Москвы» 1970. №7.
[19] Steinhardt. Stadtehygiene. 1S. 1956.
[20] Naumman E. «Das gas nnd Wassertach» 1952. NY.p.81.
[21] Dickerman J.M. etral. Journ of New England Water Works Ass. 1.11.1954.
[22] Шалашова Е.С. «Примнение озона для чистки воды жил-ком хозяйства» №6. 1960.
[23] Thorp C.E Jnd Med and Surg. 1950. v19 p 49.
[24] М.У. 2.1.2.694-98. «Использование ультрафиалетового измерении при обеззараживании воды плавательных бассейнов».
[25] Г.И. Рогожкин. «Очистка и обеззараживание воды в бассейнах» Сантехника. 4.2003. стр 4-9.